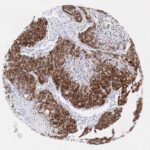
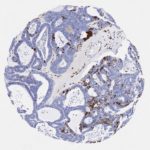
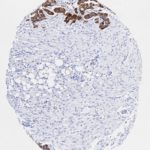
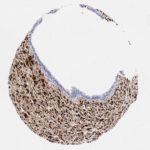
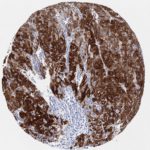
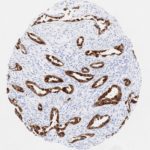
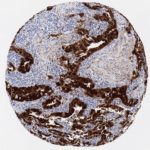
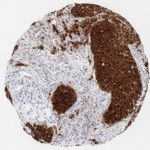
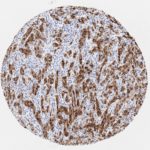
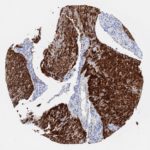
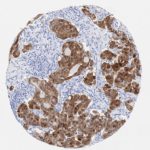
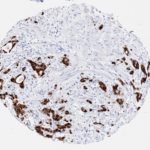
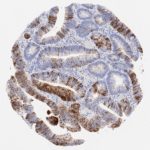
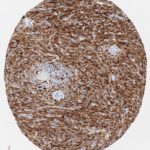
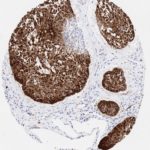
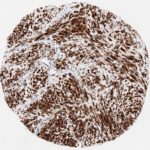
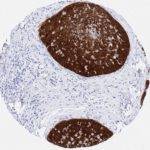
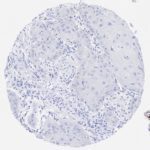
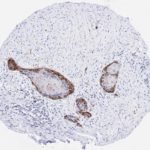
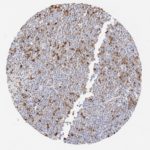
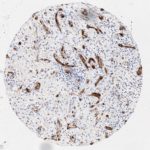
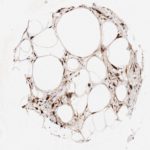
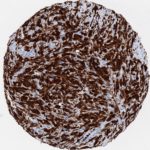
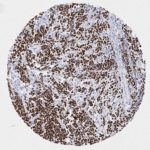
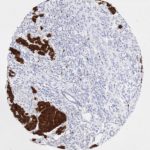
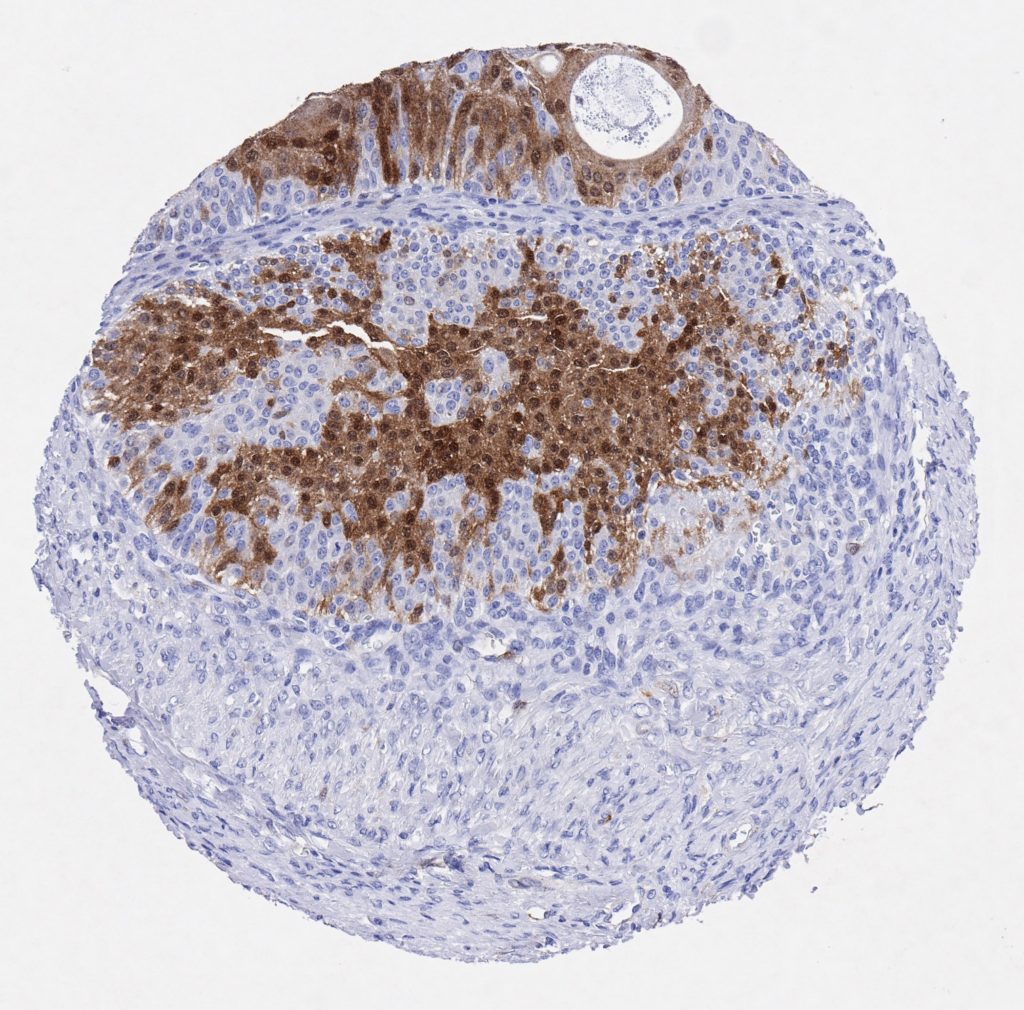
P16 spielt eine wichtige Rolle bei der Regulation des Zellzyklus. Es ist das wichtigste Mitglied der Ink4-Familie der Inhibitoren der cyclinabhängigen Kinase (CDK). Die Bindung von p16 hemmt die Bildung eines aktiven CDK4/6-Komplexes und die nachfolgende Phosphorylierung des Retinoblastom (Rb)-Proteins. Da die Phospohorylierung des Rb-Proteins ein kritischer Schritt für das Fortschreiten des Zellzyklus von der G1- zur S-Phase ist, führt die p16-Bindung an die vorgeschaltete Kinase zum Stillstand des Zellzyklus. Folglich ist p16 ein negativer Regulator der Zellproliferation und damit ein starker Tumorsuppressor.
Ca. 50% aller menschlichen Krebsarten zeigen eine Inaktivierung von p16, darunter Kopf- und Halskrebs, Ösophagus-, Gallenwegs-, Leber-, Lungen-, Blasen-, Kolon- und Brustkrebs, Leukämie, Lymphome und Glioblastome. Darüber hinaus wurde neben der Senkung der p16-Regulation bei Krebs auch eine p16-Überexpression bei HPV-(humanes Papillomavirus)-verwandten Tumoren, Gebärmutterhalskrebs und Plattenepithelkarzinomen des Kopfes und Halses beobachtet. Der p16-Rb-Signalweg ist ein Ziel für virale Onkoproteine. Das E7-Onkoprotein aus HPV inaktiviert Rb. Die p16-Überexpression in HPV-assoziierten Tumoren ist somit Ausdruck einer Dysregulation des Zellzyklus durch einen erfolglosen Versuch, die Zellproliferation zu stoppen.
p16 ist ein wichtiger immunhistochemischer (IHC) Marker in der gynäkologischen Pathologie.